El Grafito
El grafito es una de las formas elementales en las que se puede presentar el carbono.
Otras formas bien conocidas son el diamante y los fulerenos. El grafito también se llama plumbagina o plomo negro.

El grafito y el diamante son dos formas cristalinas; el grafito es la forma estable a presiones y temperaturas bajas. Se puede convertir en diamante aumentando la temperatura y la presión, y utilizando un catalizador para aumentar la velocidad.
El grafito se encuentra en la naturaleza y se puede extraer, pero también se produce artificialmente.
Estructura laminar del grafito (ABAB). Entre capas la interacción es débil, siendo la distancia de 3.35 Å, mientras que los enlaces carbono-carbono son de 1.42 Å
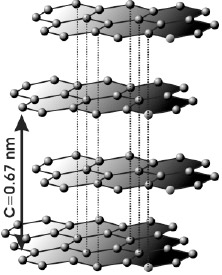 En el grafito los átomos de carbono forman capas paralelas, apiladas una encima de la otra. Dentro de una capa los átomos de carbono están enlazados a otros tres. Entre capas hay una distancia de 3.35 Å, indicando que entre éstas sólo hay interacciones débiles. Por esto, las capas se pueden deslizar fácilmente entre sí; el grafito es untuoso al tacto y un buen lubricante.
En el grafito los átomos de carbono forman capas paralelas, apiladas una encima de la otra. Dentro de una capa los átomos de carbono están enlazados a otros tres. Entre capas hay una distancia de 3.35 Å, indicando que entre éstas sólo hay interacciones débiles. Por esto, las capas se pueden deslizar fácilmente entre sí; el grafito es untuoso al tacto y un buen lubricante.
Dentro de una capa un carbono se enlaza a otros tres mediante un enlace σ, por lo que sobra un electrón que forma un sistema de enlaces π. La distancia entre estos átomos de carbono es algo mayor que en el benceno.
Las capas suelen estar apiladas de dos formas: en una estructura ABAB (forma hexagonal), en donde en dos capas alternadas los átomos de carbono están a la misma altura (como en la figura), o en una estructura ABCABC (forma romboédrica), cada tres capas.
Se puede fabricar cociendo una mezcla de coque de petróleo y de brea de carbón a 950 °C durante un tiempo que oscila entre 11 y 13 semanas, transfiriendo luego el producto cocido a un horno eléctrico a una temperatura cercana a 2.800 °C durante 4 o 5 semanas. El proceso es, en su mayor parte, una técnica de altas temperaturas, pero es también un procedimiento de refinado, ya que casi todas las impurezas de los óxidos metálicos del carbón en bruto se reducen a metal y se evaporan.
Propiedades
Es de color negro con brillo metálico, refractario y se exfolia con facilidad. En la dirección perpendicular a las capas presenta una conductividad de la electricidad baja, que aumenta con la temperatura, comportándose pues como un semiconductor. A lo largo de las capas la conductividad es mayor y disminuye al aumentar la temperatura, comportándose como un conductor semimetálico. Es polimorfo.
Aplicaciones
- El grafito es un material refractario y se emplea en ladrillos, crisoles, etc.
- Es un buen lubricante sólido, debido al deslizamiento de las capas
- Se emplea en la fabricación de diversas piezas en ingeniería, como pistones, juntas, arandelas, rodamientos, etc.
- Es conductor de la electricidad. Se emplea para la fabricación de electrodos. También tiene otras aplicaciones eléctricas.
- Se emplea en reactores nucleares, como moderador y reflector.
- El grafito mezclado con una pasta sirve para la fabricación de lápices.
- Se usa para crear discos de grafito parecidos a los discos de vinilo.
Compuestos de intercalación de grafito
Distintas moléculas o iones pueden penetrar en las capas del grafito. Por ejemplo el potasio puede ceder un electrón al grafito, quedando el ion de potasio, K+, entre las capas. Este electrón contribuye a aumentar la conductividad que presentaba el grafito.
Se pueden preparar diferentes compuestos de intercalación con distintas estequiometrías y distintas especies. En algunos casos la conductividad resultante es mayor, como en el caso del potasio, y es lo que ocurre generalmente, pero en otros, como por ejemplo con flúor, es menor.
Otras formas relacionadas
Existen otras formas llamadas de carbón amorfo que tienen una estructura relacionada con la del grafito:
- Carbón vegetal y carbón activado
- Negro de humo u hollín

